Indagine FDA sulle app mediche per smartphone
31 Maggio 2013 Pubblicato da Pino Bruno
- 31 Maggio 2013
- APPROFONDIMENTI, ATTUALITA', SCENARI DIGITALI
- applicazioni, e-Healt, medicina, sanità pubblica, smartphone
- 2 Commenti
Con la salute non si scherza. Ci sono almeno quarantamila applicazioni mediche per smartphone. Sono davvero idonee? I risultati hanno valenza scientifica? La Food and Drug Administration (FDA), l’Authority statunitense che si occupa della regolamentazione dei prodotti alimentari e farmaceutici, vuol vederci chiaro. Nei giorni scorsi ha avviato la sua prima indagine. Nel mirino una app che fa l’esame delle urine. James L. Woods, vice direttore della FDA, ha scritto alla Biosense Technologies Private Limited per sottolineare la mancanza di approvazione dell’analizzatore di urine uCheck, software che elabora la diagnosi attraverso l’analisi dei campioni di urine con la fotocamera del dispositivo.
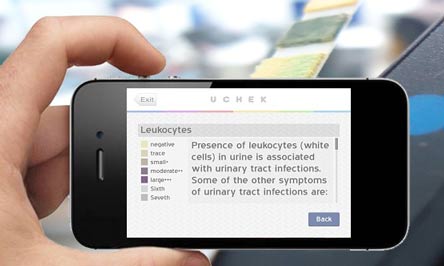 L’applicazione usa la fotocamera per l’osservazione e l’analisi della cartina standard utilizzata per la lettura del campione delle urine, prodotta da Siemens e Bayer. In questi video di Biosense Technologies è illustrata tutta la procedura.
L’applicazione usa la fotocamera per l’osservazione e l’analisi della cartina standard utilizzata per la lettura del campione delle urine, prodotta da Siemens e Bayer. In questi video di Biosense Technologies è illustrata tutta la procedura.
La lettera della FDA relativa a uChek è un precedente. Un monito ad altri sviluppatori di applicazioni non regolamentate ma utilizzate in ambito clinico.
Lo scorso marzo la FDA aveva dichiarato al Congresso degli Stati Uniti che l’Authority “non ha alcuna intenzione di soffocare l’innovazione in questo settore stimolante e in rapida crescita. In realtà solo una parte di applicazioni mobili richiederebbe la revisione della FDA. Tuttavia, quando una app mobile fa il lavoro di un dispositivo medico che richiede l’approvazione FDA, è logico che entrambi dovrebbero essere disciplinati dalle stesse regole. C’è una piccola percentuale di applicazioni mobili che comportano un rischio di malattia grave o di morte per i pazienti. Per questo la FDA diffonderà presto un documento che contenga linee guida definitive, per aiutare le aziende a valutare se, per il loro prodotto, sia necessaria o meno l’approvazione FDA”.
La risposta di Biosense Technologies non si è fatta attendere. “Nei prossimi mesi abbiamo intenzione di lavorare a stretto contatto con la FDA degli Stati Uniti per assicurare che continuiamo a fornire diagnosi accurate, a prezzi accessibili e convenienti in tutto il mondo”.
Fonte: U.S. Food and Drug Administration
PS. Strano, perché se si fa una ricerca sul sito della FDA, risulta una registrazione del sistema uChek urine analyzer di Biosense Technologies Pvt Ltd come “a Class 1 Medical Device”. Il link è questo: http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm?lid=377499&lpcd=KQO . Possibile che il vice direttore James L. Woods non se ne sia accorto?